Ácidos carboxílicos
[ad_1]
Geral e propriedades dos ácidos carboxílicos.
a ácidos carboxílicos são ácidos orgânicos caracterizados pela presença de grupo carboxílico (-COOH).
Muitos desses ácidos foram isolados pela primeira vez das gorduras e, portanto, às vezes são chamados de ácidos graxos.
Nomenclatura de ácidos carboxílicos.
No Nomenclatura IUPAC de ácidos carboxílicosA primeira cadeia que contém o carbono carboxílico deve primeiro ser identificada.
Sufixoou do alcano correspondente é substituído pelo sufixo –oic e a palavra foi pressionada ácido.
Se o grupo -COOH estiver vinculado a um ciclo, o ácido poderá ser nomeado usando o sufixo –carboxílico.
Por exemplo:
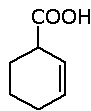
O composto é chamado: ácido 2-ciclohexenocarboxílico.
Ainda usado no entanto eu nomes tradicionais, geralmente derivado de palavras latinas ou gregas que indicam a fonte original.
Os dez primeiros termos da série de ácidos carboxílicos de cadeia não ramificada são mostrados na tabela a seguir:

* = do grego, pônei de prótonsPrimeiro gordo.
Para o Nomenclatura IUPAC de ácidos carboxílicos substituídos, a cadeia é numerada de modo que o carbono carboxílico seja o mais baixo possível.
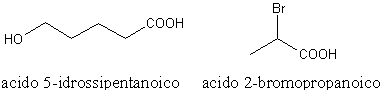
No Nomenclatura tradicional de ácidos carboxílicos substituídos, em vez disso, a posição dos substituintes é indicada pelas letras gregas (α = alfa, β = beta, γ = gama, δ = delta), no entanto, partindo do átomo de carbono adjacente ao carbono carboxílico.
Portanto, os ácidos acima terão os seguintes nomes:
ácido δ-hidroxi-pentanóico
isto é
ácido α-bromopropanóico
Caracteristicas
Os ácidos carboxílicos são compostos polares que podem se ligar facilmente em pares, formando ligações de hidrogênio entre o carbonil de um ácido e o hidroxi do outro e vice-versa:
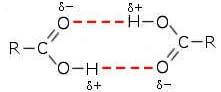
Como conseqüência, os ácidos carboxílicos têm pontos de ebulição bastante altos, ainda mais altos, com a mesma massa molecular que os álcoois correspondentes. Por exemplo, ácido acético e álcool. norte-propil tem a mesma massa molecular (60 u), mas ferve a 118 ° C e 97 ° C, respectivamente.
A acidez dos ácidos carboxílicos.
Numa solução aquosa, os ácidos carboxílicos se dissociam para formar um ânion carboxilato (RCOO–) já íon hidrogênio (H+) de acordo com o seguinte saldo:
RCOOH <==> RCOO– + H+
A forte acidez dos ácidos carboxílicos é devida a dois fatores: o efeito de ressonância e o efeito indutivo.
Efeito de ressonância
Se compararmos a acidez do ácido acético (CH3COOH) com etanol (CH3CHdoisOH), notamos que o primeiro é cem bilhões de vezes mais ácido que o etanol:
CH3COOH <==> CH3COO– + H+ (Ka = 10-5)
CH3CHdoisOh <==> CH3CHdoisOU– + H+ (Ka = 10-dezesseis)
no íon etilado (CH3CHdoisOU–) de fato, a carga negativa está no átomo de oxigênio, enquanto no íon acetato (CH3COO–) a carga negativa é deslocalizada pelo efeito de ressonância entre os dois átomos de oxigênio:
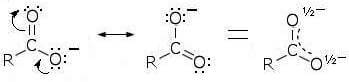
O íon acetato é estabilizado por ressonância. e isso o torna particularmente estável. Portanto, o equilíbrio da equação química:
CH3COOH <==> CH3COO– + H+
é mais deslocado para a direita do que a equação
CH3CHdoisOh <==> CH3CHdoisOU– + H+
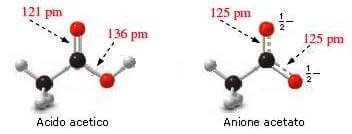
Dados físicos confirmam a ressonância do íon acetato. De fato, no ácido acético, as duas ligações carbono-oxigênio têm comprimentos diferentes, enquanto no íon acetato ambas as ligações carbono-oxigênio são idênticas e seu comprimento tem um valor intermediário entre o de uma ligação simples e o de uma ligação dupla de carbono. -oxigênio:
Efeito indutivo
Um fator muito importante que determina variações consideráveis no valor da acidez dos ácidos carboxílicos é o tipo de grupo ligado ao carboxil: os grupos de atração de elétrons causam um aumento na acidez, enquanto os grupos de dispersão de elétrons fazem com que ela diminua.
Tome o ácido cloroacético como exemplo: o cloro ligado ao carbono α (alfa) ao grupo carboxílico, sendo um elemento altamente eletronegativo, tem um efeito de atração de elétrons que estabiliza o íon cloroacetato:
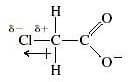
Por outro lado, grupos alquil (–CH3) são repelentes de elétrons fracos e, portanto, acentuam a carga negativa no oxigênio do íon carboxilato e, portanto, causam uma diminuição na acidez. Por esse motivo, o ácido acético (CH3COOH) é aproximadamente 12 vezes mais fraco que o ácido fórmico (HCOOH).
Ácidos que possuem dois grupos carboxílicos são chamados ácidos dicarboxílicos.
Exercícios sobre ácidos carboxílicos.
Você pode encontrá-los no seguinte link: exercícios sobre ácidos carboxílicos.
Se você estiver interessado em um software que permita desenhar moléculas, vá para a próxima página: como usar o ChemSketch.
Por fim, deixamos alguns links que podem lhe interessar:
O que é ácido trifluoroacético?
Qual é a diferença entre ácidos graxos saturados e insaturados?
ácido cloroacético
ácido ftálico
ácido cítrico
Estude conosco
[ad_2]
Source link
