Calor latente de fusão e vaporização.
[
calor latente de fusão e calor latente de vaporização
A lei fundamental da termologia nos ensina que ao fornecer (ou subtrair) calor Q a um corpo de massa m, sua temperatura aumenta (ou diminui) de um valor inicial t1 para um valor final tdois de acordo com a equação:
Q = m C Δt
No qual:
Q é a quantidade de calor trocada (J)
m é a massa do corpo (kg)
c.s é o calor específico do corpo J/(kg K)
Δt é a diferença de temperatura tdois -t1 (k)
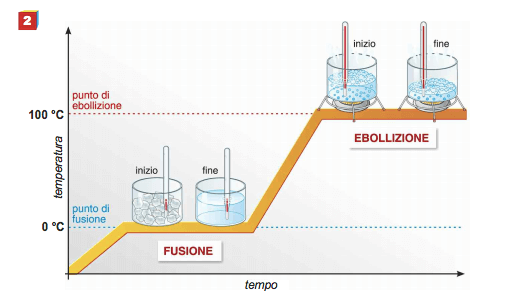
No entanto, esta lei nem sempre é válida; em particular nas mudanças de estado (ebulição, fusão, solidificação, etc.) adicionando (ou subtraindo) calor a temperatura do corpo, ao contrário do que foi dito acima, permanece constante.
As mudanças de estado das substâncias puras ocorrem de fato a temperaturas muito precisas e características de cada substância; estas temperaturas permanecem constantes durante todo o processo.
calor de fusão latente
No caso do derretimento do gelo, por exemplo, a temperatura permanece constante durante todo o processo, mesmo que o sistema continue absorvendo energia da vizinhança na forma de calor. Essa quantidade de energia é chamada calor de fusão latente.
No caso da fusão, o calor absorvido é utilizado para vencer as forças de coesão que mantêm as moléculas fixas, próximas umas das outras.
calor latente de ebulição
Assim como a fusão, a fervura também é um processo que consome energia. o Calor latente de vaporização (ou ebulição), proporcionada durante a ebulição da substância, é utilizada para enfraquecer as forças de coesão entre as partículas do líquido, permitindo que elas se afastem até passarem para o estado de vapor.
Latente significa “o que não se vê” (do latim mais tardepermanecem ocultos) porque, como mencionado acima, a absorção de calor não se manifesta com o aumento da temperatura.
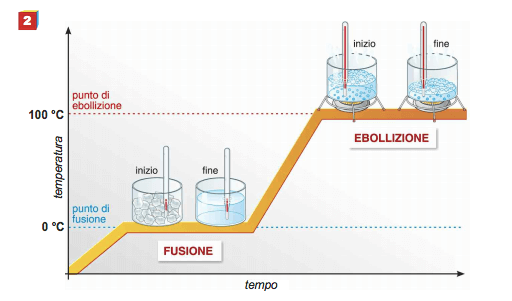
Curva de aquecimento da água destilada: observa-se que durante a fusão e a ebulição a temperatura permanece constante. O calor fornecido nessas mudanças de estado é chamado de latente.
Definição de calor latente de fusão e vaporização.
O calor latente de fusão (λF) é a quantidade de energia necessária para derreter completamente 1 g de substância na temperatura de fusão.
Considerando a transição do estado líquido para o estado de vapor, podemos definir o calor latente de vaporização (λv) como a quantidade de energia necessária para evaporar completamente 1 grama de substância à temperatura de ebulição.
Calores latentes de vaporização e fusão são medidos em joules por grama de substância (J/g); são propriedades intensivas da matéria e características de todas as substâncias puras.
Tabela de calor latente de fusão e ebulição de algumas substâncias
A tabela a seguir mostra o calor latente de fusão de algumas substâncias:

Calor latente de fusão de algumas substâncias.
A tabela a seguir mostra o calor latente de ebulição de algumas substâncias:

Calor latente de ebulição de algumas substâncias.
O calor necessário para a fusão de uma quantidade de substância de massa m pode ser determinado pela aplicação da seguinte fórmula:
Q = metro λF
no qual:
m = massa da substância (g)
λF = calor latente de fusão (J/g)
Q = quantidade de calor absorvido (J)
cujas fórmulas inversas são:
m = Q / λF
λF = Q/metro
O calor necessário para a vaporização de uma quantidade de substância de massa m pode ser determinado pela aplicação da seguinte fórmula:
Q = metro λv
no qual:
λv = calor latente de vaporização (J/g)
cujas fórmulas inversas são:
m = Q / λv
λv = Q/metro
Exercício 1
Vamos dar um exemplo para esclarecer ideias.
Suponha que queremos determinar a quantidade de calor necessária para derreter um cubo de gelo com massa de 120 g que está a uma temperatura de 0 °C. O calor latente de fusão do gelo é de 333,5 J/g.
Realização do exemplo
Como mencionado acima, o calor necessário para a fusão de uma quantidade de gelo de massa m pode ser determinado pela aplicação da seguinte fórmula:
Q = metro λF
no qual:
m = massa de gelo (g)
λF = calor latente de fusão (J/g)
Q = quantidade de calor absorvido (J)
Eu nosso caso:
m=120g
λF = 333,5J/g
Q=?
Ao substituir adequadamente os dados que temos à nossa disposição, temos que:
Q = metro λF = 120333,5 = 40,020J
Portanto, para derreter 120 g de gelo a uma temperatura de 0 °C, é necessário fornecer uma quantidade de calor igual a 40.020 J.
Isso significa que ao fornecer essa quantidade de calor, toda a água do balde passará do estado sólido para o estado líquido, mantendo sempre a temperatura de 0°C.
Se a quantidade de calor que forneceremos for inferior a 40.020 J, apenas parte do gelo derreterá, enquanto o restante permanecerá sólido.
Se, por outro lado, a quantidade de calor que vamos fornecer for superior a 40.020 J, não só todo o gelo derreterá, mas com o excesso de calor aqueceremos ligeiramente a água a uma temperatura de pouco mais de 0ºC.
Calor latente e mudanças de estado.
Cada transição de estado corresponde ao seu próprio calor latente.
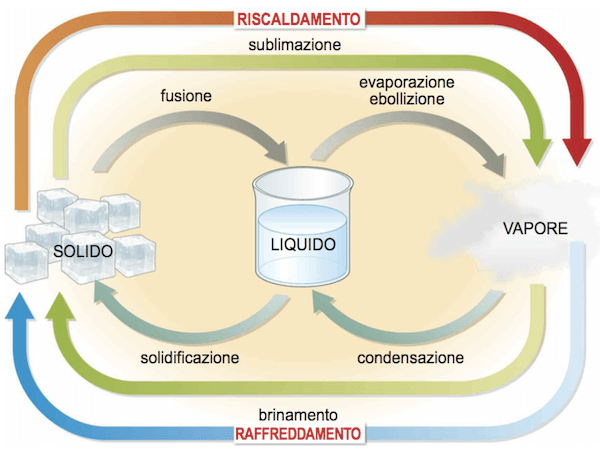
transições de estado.
Para a fusão temos calor de fusão latente.
Para fervura (ou evaporação) temos calor fervura fervente (ou evaporação).
Para a condensação temos calor latente de condensação; é numericamente igual, mas de sinal oposto ao calor latente de vaporização.
Para solidificação temos calor latente de solidificação; é numericamente igual, mas de sinal oposto ao calor latente de fusão.
Para sublimação temos o calor latente de sublimação.
Para geada temos calor latente de geada; é numericamente igual, mas de sinal oposto ao calor latente de sublimação.
Calor latente de fusão e vaporização molar
No caso de o calor latente ser expresso por mol de substância e não por grama, falamos de calor latente de fusão molar e de calor latente de vaporização molar.
No SI, o calor latente molar é expresso em J/mol.
Para mais informações, veja também: energia térmica e mudanças de estado.
Exercício #2 (alto nível de dificuldade)
Um poderoso laser fornece uma potência de 109 É dirigido contra uma certa quantidade de água que está a uma temperatura de 30°C.
Sabendo que o laser dispara 10 pulsos cada um com duração de 10-8 s Calcule a massa de água que evapora.
O calor latente de vaporização da água é conhecido como 2,25 ∙ 106 J/kg.
O desenvolvimento do exercício pode ser encontrado aqui: exercício sobre a lei de Regnault.
Links Relacionados:
Quanto vale o calor latente da água?
O que é calor sensível?
Qual é a curva de resfriamento de uma substância pura?
estude conosco