Como atribuir o número de oxidação em compostos orgânicos
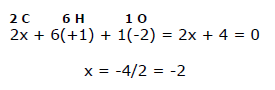
[ad_1]
Reações redox em química orgânica
As reações redox (ou reações redox) são reações em que há troca de elétrons entre duas espécies químicas; uma espécie sofre uma reação de oxidação, a outra espécie sofre uma reação de redução.
Em química orgânica, as reações redox afetam essencialmente o átomo de carbono e alteram seu estado de oxidação.
Em compostos orgânicos, o átomo de carbono pode assumir todos os números de oxidação entre -4 e +4..
Atribuir números de oxidação aos vários átomos de carbono em um composto orgânico não é particularmente difícil; neste sentido é possível determinar o valor médio do número de oxidação do átomo de carbono em um composto orgânico mas, não se deve esquecer, que os diferentes átomos de carbono dentro do composto também podem ter números de oxidação diferentes.
Como atribuir o número de oxidação em compostos orgânicos
Para a atribuição de números de oxidação em compostos orgânicos, as mesmas regras são seguidas para a atribuição de números de oxidação em compostos inorgânicos.
Vamos considerar alguns exemplos.
Em etanol CH3CHdoisOH existem seis átomos de hidrogênio (cada um com número de oxidação nox = +1); um átomo de oxigênio (nox = -2) e dois átomos de carbono (nox =?). Lembrando que em um composto neutro a soma dos números de oxidação deve ser igual a zero, temos que:
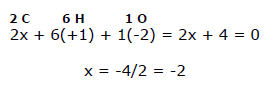
Portanto, o valor médio do número de oxidação de cada átomo de carbono é -2.
No eteno existem quatro átomos de hidrogênio (cada um dos quais tem nox = +1) e dois átomos de carbono (nox =?). Neste caso temos que:
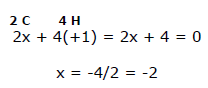
Também neste caso o valor médio do número de oxidação de cada átomo de carbono é -2.
Os valores que acabamos de encontrar, no entanto, são valores médios, já que diferentes átomos de carbono dentro das moléculas podem até assumir diferentes números de oxidação..
Se você quiser atribuir a cada átomo de carbono seu próprio número de oxidação, você deve proceder de forma diferente.
Primeiro precisamos desenhar a estrutura de Lewis.
Em caso deetanol a ligação entre os átomos de carbono é covalente pura (na verdade, a diferença de eletronegatividade entre os dois átomos é zero) e, portanto, os elétrons de ligação não são atribuídos a nenhum dos dois átomos.
O carbono metil, sendo mais eletronegativo que o átomo de hidrogênio, recebe três elétrons dos três átomos de hidrogênio ligados a ele e, portanto, assume número de oxidação -3.
O outro átomo de carbono assume o número de oxidação -1, uma vez que os dois átomos de H contribuem com uma carga formal total -2 (cada átomo de hidrogênio cede seu elétron ao carbono), enquanto o átomo de oxigênio contribui com uma carga formal +1 (neste caso é o carbono que cede seu elétron para o oxigênio).
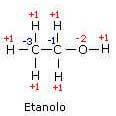
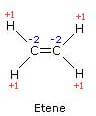
Em caso deeteno os elétrons da ligação dupla não são atribuídos a nenhum dos dois átomos, enquanto cada átomo de carbono recebe dois elétrons dos átomos de hidrogênio ligados a ele.
Portanto, o número de oxidação de cada átomo de carbono é -2, enquanto o número de oxidação de cada átomo de hidrogênio é +1.
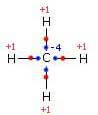
Na molécula de metano o átomo de carbono, sendo mais eletronegativo que o hidrogênio, atrai para si os elétrons compartilhados na ligação covalente e adquire o número de oxidação -4. Cada átomo de H tem um número de oxidação +1.
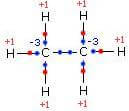
na molécula deetano a ligação entre os átomos de carbono é covalente pura e, portanto, entre os dois átomos de carbono não há atribuição do número de oxidação. No entanto, cada átomo de carbono recebe três elétrons de três átomos de hidrogênio e, portanto, assume o número de oxidação -3. Em vez disso, cada átomo de H adquire um número de oxidação +1.
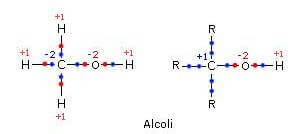
um átomo de carvão alcoólico ele pode ter um número de oxidação entre -2 e +1 dependendo do número de grupos alquil ligados a ele (elétrons na ligação entre o átomo de carbono e o grupo alquil não são atribuídos a nenhum dos átomos).
a carbono de um aldeído pode ter um número de oxidação de 0 ou +1, enquanto o de um cetona Tem número de oxidação +2.
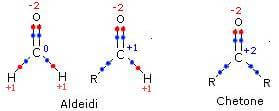
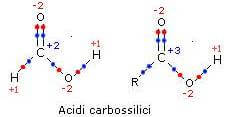
a carbono carboxílico pode levar o número de oxidação +2 ou +3.
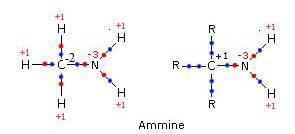
EU’nitrogênio amino assume número de oxidação -3.
estude conosco
[ad_2]
Referências