Eletroquímica

[ad_1]
Eletroquímica: células galvânicas e eletrólise.
A eletroquímica é o ramo da química que estuda os fenômenos relacionados à transformação da energia de ligação química em energia elétrica e vice-versa..
Uma reação redox é uma reação na qual os elétrons passam espontaneamente de uma substância que oxida para uma substância que é reduzida.
Ao causar uma reação redox não diretamente, mas forçando os elétrons trocados a passar através de um fio elétrico externo, é possível explorar esse tipo de reação para produzir uma corrente elétrica.
Esse processo é possível e é realizado em dispositivos conhecidos como células galvânicas ou baterias.

As células-botão são um exemplo de células galvânicas.
Por outro lado, ao fornecer energia elétrica ao sistema, é possível causar uma reação redox na direção oposta à espontânea.
Nesse caso, a energia elétrica é convertida em energia de ligação química. Esse processo é realizado em dispositivos conhecidos como Células eletroquímicas. O processo é chamado de eletrólise.
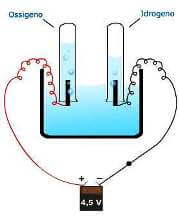
Ao consumir eletricidade, hidrogênio e oxigênio podem ser produzidos a partir da água em uma célula eletrolítica.
Diferença entre células galvânicas e células eletrolíticas.
Em conclusão:
ele células galvânicas Eles produzem eletricidade explorando reações espontâneas de redução à oxidação. Neles, a energia química de ligação é convertida em eletricidade.
ele células eletrolíticas eles consomem eletricidade para produzir reações não espontâneas de redução da oxidação. Neles, a energia elétrica é convertida em energia química de ligação.
Exercícios sobre eletrólise.
Você pode encontrá-los no seguinte link: exercícios sobre eletrólise.
Por fim, deixamos alguns links que podem lhe interessar:
O que é eletrodiálise?
O que é eletrossmose e para que é usada?
Qual é a diferença entre ânodo e cátodo?
Estude conosco
[ad_2]
Source link
