Eliminação E1
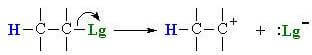
[ad_1]
Eliminação unimolecular E1
Como as reações de substituição nucleofílica podem ser de primeira ordem (SNão.1) e segunda ordem (SNão.2), assim também a ß-eliminação pode ter dois mecanismos diferentes (representados pelas siglas E1 e E2).
Eliminação E1
Lá E1 é um reação de eliminação unimolecular em que a velocidade da reação depende apenas da concentração do substrato (haleto de alquila) e é independente da concentração da base (cinética de primeira ordem).
A lei cinética desta reação é, portanto, do tipo: v = k [R-Lg].
A reação ocorre em duas etapas:
1ª etapa
Na primeira etapa da reação (estágio lento) ocorre o desprendimento do grupo de saída com a formação de um carbocatião:
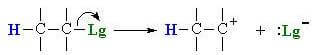
2º estágio
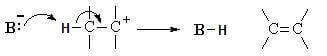
Na segunda fase da reação (fase rápida) a base B– remove um átomo de hidrogênio ß do carbocátion para formar um alceno.
A etapa que determina a velocidade da reação é a ionização do haleto para formar o carbocátion. Esta etapa determina e limita a velocidade de todo o processo (é a Etapa de Determinação da Taxa). RDS).
Íon B–além de atuar como base, também pode atuar como nucleófilo e atacar o centro de carbocatião para dar a reação de substituição SNão.1.
A condição de reação que é usada principalmente para variar as quantidades relativas dos produtos nas duas reações concorrentes (E1 e SNão.1) é a temperatura: geralmente, o aumento da temperatura favorece a reação de eliminação.
Na eliminação de E1, a etapa determinante da velocidade é aquela que leva à formação do intermediário da reação carbocátion.
Quanto mais estável for o intermediário da reação do carbocatião, mais rápida será a reação.
Portanto, a ordem de reatividade da reação E1 segue a ordem de estabilidade dos carbocátions:
terciário > secundário > primário > metil
Além disso, a formação de produtos de substituição em vez de produtos de eliminação é favorecida por solventes nucleofílicos polares e pela ausência de bases fortes.
Regiosseletividade em reações E1
Se a base pode atacar dois hidrogênios não equivalentes em ß, o átomo de hidrogênio que se perde é geralmente aquele correspondente à formação alquímica mais ramificada (regra de Saytzev). Esta regra é válida para ambas as reações E1 e E2.
estude conosco
[ad_2]
Referências
