Estado da matéria – Wikipedia
[ad_1]
Da Wikipédia, a enciclopédia livre.
Com Estado da matéria (ou estado de agregação de moléculas) significa uma classificação convencional de estados que a matéria pode assumir de acordo com as propriedades mecânicas que ela manifesta.
A distinção entre os estados da matéria é feita historicamente com base nas seguintes diferenças qualitativas:
- uma matéria em estado sólido tem seu próprio volume e forma;
- uma matéria líquida tem seu próprio volume, mas assume a forma do recipiente que a contém;
- uma questão no ar não tem seu próprio volume ou forma, mas se expande para ocupar todo o espaço disponível.
- A matéria no estado plasma pode se parecer com um gás sem ter sua própria forma e pode se expandir como um aeriforme, do qual se distingue por sua ionização.
- Uma questão no estado condensado de Bose-Einstein é uma nuvem de átomos ultra-frios de alta densidade com o comportamento de um super átomo.

Sólido[[[[modificação O | editar wikitext]
No estado sólido, os componentes da matéria são unidos por forças muito intensas que apenas permitem vibrações, na maioria dos casos as moléculas são distribuídas de acordo com uma rede cristalina ou de maneira amorfa. A única maneira de variar a forma de um sólido é aplicar forças suficientemente fortes para romper os laços, fazendo com que o corpo se quebre ou corte.
Líquido[[[[modificação O | editar wikitext]
No estado líquido, as forças entre os componentes da matéria são menos intensas e livres para fluir umas sobre as outras. Um líquido sofre mudanças de volume muito menos acentuadas em comparação aos gases, tanto que, na linguagem comum, é incorretamente dito que o volume de líquidos não varia, mas isso não é verdade: sim, com a mesma variação de temperatura Dt ou variação de pressão AP, a alteração no volume de líquidos é muito menor que a alteração no volume de gases e tende a assumir a forma do recipiente no qual está contido.
aeriforme[[[[modificação O | editar wikitext]
No estado aeriforme, as interações são extremamente fracas e os componentes podem se mover de forma independente; portanto, eles não têm forma própria e tendem a expandir e ocupar todo o volume disponível, tornando-os compressíveis.
Os detalhes aeriformes são gases, vapores e fluidos supercríticos.
Plasma[[[[modificação O | editar wikitext]
O estado do plasma é semelhante a um gás, mas é ionizado e consiste em um conjunto de elétrons e íons e é globalmente neutro (cuja carga elétrica total é zero). Como tal, o plasma é considerado o quarto estado da matéria, que portanto difere de sólido, líquido e aeriforme, enquanto o termo “ionizado” indica que uma fração significativamente grande de elétrons foi retirada de seus respectivos átomos.
Condensado de Bose-Einstein[[[[modificação O | editar wikitext]
O condensado é formado quando os bósons são resfriados a temperaturas imediatamente acima do zero absoluto. Nesse estado, a maioria das partículas de condensado ocupa o estado quântico de energia mínima e efeitos quânticos (como a superposição de suas funções de onda), que geralmente são relevantes apenas em escala microscópica, que também se tornou observável em nível macroscópico. Eles podem ser formados a partir de gases de baixa densidade a partir de átomos ultra-frios, ou de algumas quase-partículas dentro de sólidos, como excitons. Tem muitas semelhanças com o estado superfluido do hélio-4.
Na ciência moderna, na realidade, essa classificação simples é inadequada para descrever exaustivamente as muitas possibilidades que a matéria tem para se organizar. O plasma e o condensado de Bose-Einstein foram provavelmente os primeiros Novo estados da matéria a serem adicionados a este catálogo,[1] mas existem muitos outros que aparecem em condições particulares de temperatura e pressão:
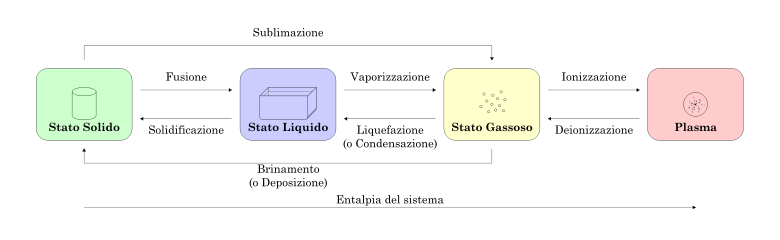
Quando a matéria está sujeita a variações de pressão e temperatura, ela pode ir para um estado diferente de agregação; portanto, ocorre uma mudança de estado.
Cada mudança de estado é caracterizada pela quebra ou formação de ligações químicas, durante a mudança de estado a temperatura do sistema permanece constante e cada substância precisa de uma certa quantidade de calor, calor latente, íons ou energia para mudar seu estado. .
As etapas de status são as seguintes:
- fusão: a transição do sólido para o líquido, ocorre com a compra de calor (processo endotérmico);
- solidificação: transição do estado líquido para o sólido, liberação de calor (processo exotérmico);
- vaporização: transição do líquido para o estado aeriforme, o calor é adquirido (endotérmico);
- condensação: a transição do estado aeriforme para o líquido ocorre com a transferência de calor (exotérmica);
- liquefação: transição do estado gasoso para o líquido por compressão, somente se o aeriforme estiver a uma temperatura abaixo da temperatura crítica (exotérmica);
- Frost: transição do estado gasoso para o sólido (exotérmico);
[2][3]
- Luigi Rolla Química e mineralogia. Para escolas secundárias, 29a ed., Dante Alighieri, 1987.
[ad_2]
Source link