Nomenclatura
[ad_1]
A nomenclatura de compostos químicos.
Os elementos químicos podem ser classificados em duas grandes categorias:
– metais
– sem metais
Os metais dão origem a uma série básica compostos, enquanto os não-metais dão origem a um série ácida. OU:
Série básica:
Metal + Odois → Óxido (básico);
Óxido (básico) + HdoisO → Hidróxido (base)
Série ácida:
Sem metal + Odois → Anidrido (óxido ácido);
Anidrido + HdoisO → Ácido (oxiácido)
Os sais (que podem ser sais binários ou ternários) são obtidos por reação de um composto da série ácida com um composto da série básica.
Nomenclatura química tradicional e nomenclatura IUPAC
Lá nomenclatura tradicional baseia-se no uso de certos prefixos e sufixos.
Lá Nomenclatura IUPAC em vez disso, usa prefixos multiplicativos apropriados para destacar o número de átomos ou agrupamentos de átomos presentes em uma molécula. Os prefixos multiplicativos são os seguintes:
1 – macaco
2 de
3 – tri
4 – sombrio
5 – penta
6 – hex
7 – epta
8 – octa
Regras para a construção de compostos binários.
Os compostos binários são compostos constituídos por apenas dois elementos químicos.
Por convenção, o elemento com a menor eletronegatividade (e, portanto, com o número de oxidação positivo) é escrito primeiro e o elemento mais eletronegativo (com o número de oxidação negativo) por segundo.
No entanto, há exceções a essa regra que diremos em casos individuais.
O símbolo para cada elemento químico é seguido por um número subscrito, chamado índice, que indica quantos átomos desse elemento estão presentes no composto.
Os índices são definidos de tal maneira que, adicionando os respectivos números de oxidação, a molécula é neutra.
Para calcular os índices de uma maneira simples, basta usar o número de oxidação do primeiro elemento como índice do segundo e vice-versa.
Por exemplo, se quisermos escrever a fórmula química de um composto binário formado por um elemento A cujo número de oxidação é +2 e por um composto B cujo número de oxidação é -3, teremos:
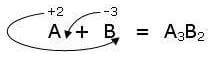
Observe que o elemento com o número de oxidação positivo (o menos eletronegativo) foi escrito primeiro.
Este método de construção de compostos binários é chamado “Regra de cruzamento“e garante a neutralidade da molécula. De fato, na molécula há um total de 3 átomos A (= 6 cargas positivas) e 2 átomos B (= 6 cargas negativas).
Se após o cálculo dos índices, eles são divisíveis pelo mesmo número, os índices devem ser simplificados.
Por exemplo, a partir de um elemento X com número de oxidação +4 e um elemento Y com número de oxidação -2, teremos o seguinte composto binário:
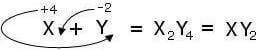
Certos compostos são uma exceção a esta regra, como peróxido de hidrogênio (peróxido de hidrogênio, pertencente à família dos peróxidos), HdoisOUdois, em que os índices não devem ser simplificados.
Exercícios sobre nomenclatura química.
Se estiver interessado, você pode encontrá-los aqui: exercícios de nomeação química.
Questionário de nomenclatura química.
Encontre-os aqui: questionários sobre nomenclatura química.
Estude conosco
[ad_2]
Source link