Definição do número quântico
Um número quântico é um valor que é usado ao descrever os níveis de energiadisponíveis para átomos e moléculas . Um elétron em um átomo ou íon tem quatro números quânticos para descrever seu estado e produzir soluções para a equação de onda de Schrödinger para o átomo de hidrogênio.
Existem quatro números quânticos:
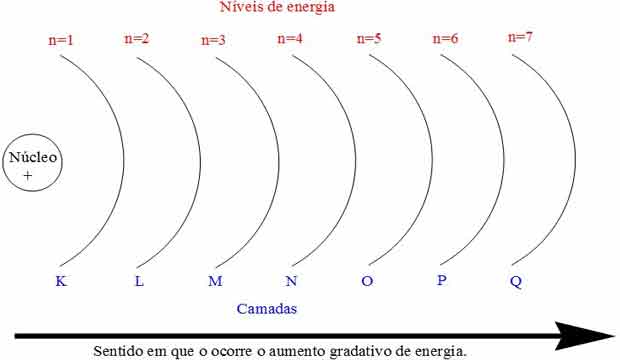
n – número quântico principal – descreve o nível de energia
ℓ – número quântico azimutal ou momento angular angular – descreve o submarino
m ℓ ou m – número quântico magnético – descreve o orbital da subscada
ms ou s – número quântico de rotação – descreve a rotação
De acordo com o princípio de exclusão de Pauli, nenhum elétron em um átomo pode ter o mesmo conjunto de números quânticos. Cada número quântico é representado por um valor meio inteiro ou inteiro.
- O número quântico principal é um número inteiro que é o número do shell do elétron. O valor é 1 ou superior (nunca 0 ou negativo).
- O número quântico do momento angular é um número inteiro que é o valor do orbital do elétron (por exemplo, s = 0, p = 1). ℓ é maior ou igual a zero e menor ou igual a n-1.
- O número quântico magnético é a orientação do orbital com valores inteiros que variam de -l a ℓ. Assim, para o orbitário p, onde ℓ = 1, m poderia ter valores de -1, 0, 1.
- O número quântico de rotação é um valor meio inteiro que é -1/2 (chamado “spin down”) ou 1/2 (chamado “spin up”).
Exemplo de número quântico
Para os elétrons de valência externos de um átomo de carbono, os elétrons são encontrados no orbitário 2p.
Não apenas para elétrons
Enquanto os números quânticos são comumente usados para descrever elétrons, eles podem ser usados para descrever os nucleons (prótons e nêutrons) de um átomo ou partículas elementares.
Útil