substituição nucleofílica SN1
[ad_1]
Substituição nucleofílica unimolecular S.Não.1
A substituição nucleofílica de haletos de alquila pode ocorrer por dois mecanismos diferentes: o mecanismo SNão.2 e o mecanismo de substituição nucleofílica S.Não.1.
Nesta seção, abordaremos o mecanismo SNão.1.
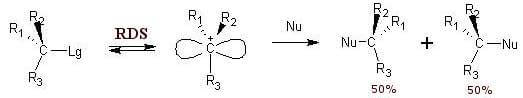
A reação SNão.1 prossegue em duas etapas: a primeira etapa determina a velocidade global da reação e prevê a formação de um intermediário carbocátion:
RX → R+ +X– (fase lenta)
O segundo estágio da reação (estágio rápido) envolve o ataque nucleofílico ao carbocátion:
r+ + não– → R-Nu (estágio rápido)
O fato de que o estágio lento proposto não envolve o nucleófilo explica a cinética de primeira ordem e também esclarece porque a velocidade inicial não muda com a mudança de nucleófilo.
A formação do intermediário carbocátion é a etapa lenta da reação que condiciona e limita a velocidade de todo o processo (é a Etapa Determinante da Velocidade). RDS).
A equação de velocidade, portanto, não contém a concentração do nucleófilo e é a seguinte: v = k [R-Lg].
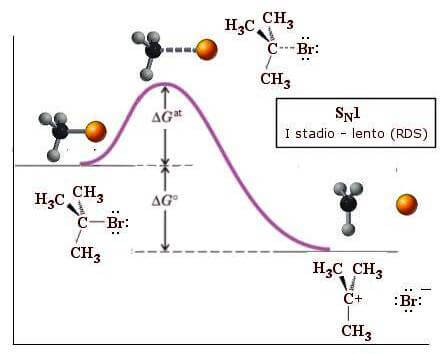
Um exemplo de uma reação que ocorre através de um mecanismo SNão.1 é a reação do brometo de tu-butila com o íon hidróxido OH–:
(CH3)3C-Br + OH– → (CH3)3C-OH + Br–
A primeira etapa da reação (estágio lento) envolve a formação do cátion tu-butila (CH3)3c.+:
O segundo estágio da reação (estágio rápido) envolve ataque nucleofílico (OH–) para o cátion tu-butilo:
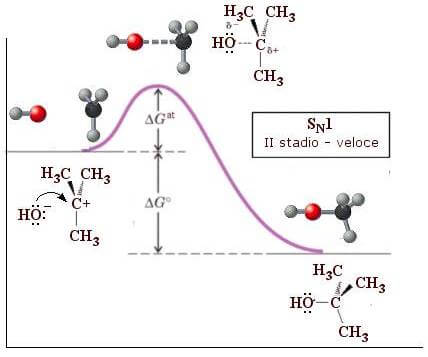
Observe que o primeiro estágio da reação, que tem uma energia de ativação (ΔGem) maior que o segundo, constitui a etapa lenta da reação e determina a velocidade de todo o processo.
Quando reage sob condições SNão.1 mostra um haleto de alquila opticamente ativo e quase completo racemização do produto final. Isso ocorre porque um carbocátion com hibridização sp é gerado como intermediário.dois planar e isso pode ser atacado pelo nucleófilo de entrada em ambos os lados com igual probabilidade.
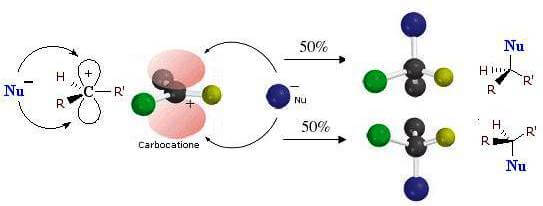
Taxas relativas de reações SNão.1
Vamos agora examinar quais efeitos a estrutura do grupo R tem nas taxas relativas das reações de substituição nucleofílica SNão.1. Como um carbocátion é gerado na formação do estado de transição, os haletos de alquila que geram os carbocátions mais estáveis reagirão mais rapidamente. Os resíduos de alquila tendem a estabilizar a cabocação por efeitos indutivos e hiperconjugativos. Assim, um carbocátion terciário é mais estável que um carbocátion secundário, que por sua vez é mais estável que um carbocátion primário. A ordem de reatividade dos haletos de alquila é, portanto:
terciário > secundário > primário > metil
Rearranjo Wagner-Meerwein
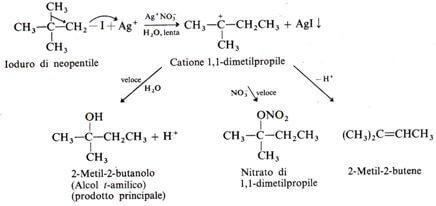
Mais uma prova de que o SNão.1 passa por um carbocátion consiste na observação de que ocorrem rearranjos; o carbocátion intermediário pode, de fato, sofrer um fenômeno de rearranjo, com uma mudança 1,2 de um alquil ou de um hidrogênio para formar um carbocátion mais substituído e, portanto, mais estável (Rearranjo Wagner-Meerwein).
Por exemplo, o iodeto de neopentil em água, na presença de nitrato de prata, se reorganiza no derivado 1,1-dimetilpropil.
resumindo
Um substituto SNão.1 tem as seguintes características:
– a reação ocorre de acordo com um mecanismo de dois estágios. A primeira etapa da reação é caracterizada pela formação de um intermediário carbocátion. Este estágio é o mais lento e, portanto, afeta a velocidade de toda a reação química.
– a cinética da reação é de primeira ordem; de fato, a velocidade da reação pode ser acelerada aumentando a concentração do haleto de alquila sozinho. A lei cinética desta reação é, portanto, do tipo: v = k [R-Lg]. O íon hidróxido não está envolvido na etapa que determina a velocidade da reação.
– a reação passa pela formação de um carbocátion intermediário com geometria trigonal plana.
– Na segunda etapa da reação, o nucleófilo ataca um dos dois lados do carbocátion intermediário com a formação da ligação R-Nu.
estude conosco
[ad_2]
Referências
