temperatura ou ponto de ebulição
[
Temperatura de ebulição: definição e explicação.
Sabe-se que uma substância pode existir em vários estados de agregação (sólido, líquido, vapor, etc.), cada um com uma faixa de estabilidade bem definida. A ebulição é a passagem de uma substância do estado líquido para o estado de vapor e a temperatura na qual ela ocorre é chamada de temperatura de ebulição.
Para entender melhor o que foi dito, examinemos a água contida em um recipiente e suponhamos que seja aquecida. Inicialmente, a temperatura da água começa a subir até atingir uma temperatura em que a água começa a ferver, ou seja, começa a se transformar em vapor. A temperatura na qual esse processo ocorre é chamada de temperatura de ebulição.
Com base no que acabamos de dizer, parece que a ebulição é a transição do estado líquido para o estado de vapor da água ou, mais geralmente, de um corpo com formação de vapor não apenas na superfície do líquido, mas em todo o corpo. .corpo. a massa. Para obter a ebulição de uma substância é necessário administrar calor do exterior.
Como será visto mais adiante, durante a fervura da água (ou de qualquer outra substância, como o álcool etílico) a temperatura permanece constante; o calor cedido durante o período de ebulição é chamado de calor latente de ebulição.
Então lembre-se disso: temperatura de ebulição é a temperatura na qual uma substância ferve; esta temperatura é mantida durante todo o tempo em que o líquido passa pelo vapor.
Influência da pressão na temperatura de ebulição
Nas altas montanhas, onde a pressão é inferior ao nível do mar (pressão atmosférica), a água ferve a uma temperatura inferior a 100 °C (100 °C é a temperatura de ebulição da água à pressão atmosférica). Na panela de pressão, onde a pressão é superior à atmosférica, a água ferve a uma temperatura superior a 100 °C.
Portanto, um líquido pode ferver a inúmeras temperaturas porque os valores que a pressão externa pode assumir são inúmeros. Quando falamos da temperatura de ebulição de um líquido sem nos referirmos à pressão, convencionalmente queremos dizer que a pressão externa é P = 1 atm.
Mas por que a pressão externa afeta a temperatura de ebulição?
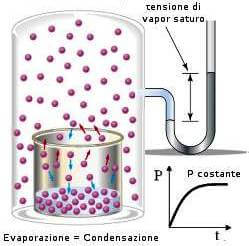
Para responder à pergunta, introduzimos uma grandeza física conhecida como pressão de vapor.
A pressão gasosa (exercida pelo vapor de água sobre o seu líquido) correspondente ao equilíbrio água-vapor de água à temperatura t, é indicada como pressão de vapor (ou pressão de vapor) da água; seu valor é constante à temperatura constante.
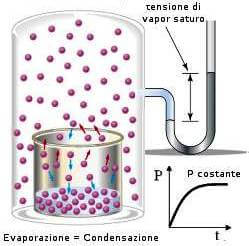
Uma vez atingido o equilíbrio líquido/vapor, a uma certa temperatura t, o vapor d’água exerce uma pressão conhecida como pressão de vapor em seu líquido.
À medida que a temperatura da água (ou de qualquer outro líquido) aumenta, sua pressão de vapor aumenta. Quando o valor da pressão de vapor atinge o valor da pressão que empurra a superfície do próprio líquido (ou seja, a pressão externa), o líquido começa a ferver, ou seja, a formação de vapor ocorre não apenas na superfície do líquido, mas em toda a massa.
A temperatura na qual isso ocorre é chamada de temperatura de ebulição, e seu valor, para o mesmo líquido, obviamente depende da pressão externa. Então A temperatura de ebulição de um líquido é aquela temperatura na qual a pressão de vapor do líquido se torna igual à pressão atmosférica..
Esta definição explica por que a temperatura de ebulição de um líquido varia com as mudanças na pressão.
Temperatura de ebulição e curva de aquecimento de uma substância pura
Consideremos os fenômenos que ocorrem durante o aquecimento progressivo de um líquido como a água.
A água é colocada num aparelho adequado que lhe fornece muito lentamente quantidades conhecidas de calor e que regista a sua temperatura. Imagine operar à pressão atmosférica e plotar as temperaturas da água em relação aos tempos de aquecimento subsequentes; Obtém-se um diagrama como o mostrado na figura a seguir.
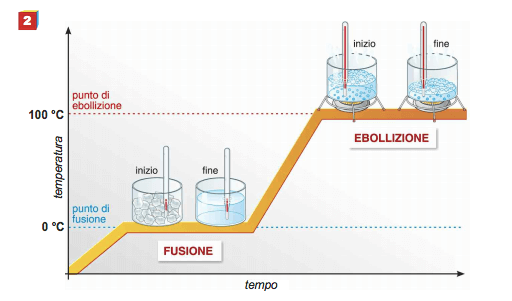
Curva de aquecimento da água destilada: observa-se que durante a ebulição a temperatura permanece constante em 100 °C (a uma pressão de 1 atm). Essa temperatura é chamada de temperatura de ebulição (ou ponto).
A partir do ponto de fusão, o calor fornecido ao líquido aumenta sua temperatura até 100 °C, a temperatura na qual a água começa a ferver.
De fato, a uma temperatura de 100 °C (e uma pressão de 1 atm), há uma energia cinética média das partículas do líquido tal que a pressão de vapor do líquido atinge o valor da pressão externa e o líquido começa ferver.
Continuando a fornecer calor, a ebulição continua, a temperatura permanece constante e o novo líquido evapora repetidamente. Na última parte da curva, todo o líquido evaporou.
Como a quantidade de calor fornecida ao líquido na etapa líquido → estado de vapor não faz com que a temperatura do líquido aumente, é atribuído o adjetivo latente. Falamos assim de calor latente de ebulição, que se se refere a um mol de líquido que passa ao estado de vapor, recebe o nome de calor latente molar de ebulição.
Temperatura de ebulição de algumas substâncias.
Relatamos os valores das temperaturas de ebulição de algumas substâncias determinadas a uma pressão de 1 atm.
Ponto de ebulição do nitrogênio (-196°C)
Temperatura de ebulição do oxigênio (-183 ° C)
Ponto de ebulição do álcool etílico (78,5°C)
Temperatura da água fervente (100 ° C)
Ponto de ebulição do mercúrio (356,7 °C)
Temperatura de ebulição do sal de cozinha (1465 °C)
Ponto de ebulição do alumínio (2327 °C)
Ponto de ebulição do ouro (2808 °C)
Links Relacionados:
Quanto vale o calor latente da água?
Qual é a curva de resfriamento de uma substância pura?
estude conosco
