aminas
[ad_1]
Geral e propriedades de aminas.
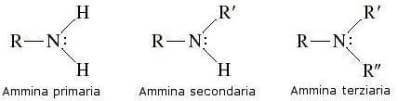
a aminas Podem ser considerados derivados orgânicos de amônia nos quais um, dois ou todos os três átomos de hidrogênio são substituídos por resíduos alquil ou aril.
Dependendo do tipo de resíduo ligado ao átomo de nitrogênio, as aminas podem ser classificadas como:
aminas alifáticas: se os resíduos são apenas alifáticos
aminas aromáticas: se pelo menos um dos resíduos for aromático
aminas heterocíclicas: se o átomo de nitrogênio fizer parte de um ciclo aromático ou alifático
Com base no número de átomos de hidrogênio substituídos, as aminas podem ser classificadas em aminas primárias, aminas secundárias isto é aminas terciárias:
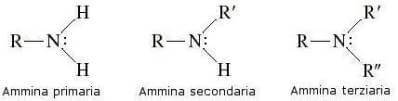
Em uma amina, o átomo de nitrogênio exibe hibridação sp3 e geometria da pirâmide:
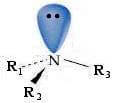
Com base nessa geometria, para uma amina terciária com diferentes grupos ligados ao átomo de nitrogênio, pode-se supor que ela tenha quiralidade e ser separável nos respectivos enantiómeros.
Na realidade, aminas desse tipo não exibem atividade óptica, uma vez que os dois enantiômeros se interconvertem, mesmo a baixas temperaturas, muito rapidamente através de um movimento semelhante a um guarda-chuva que é derrubado por uma rajada de vento:
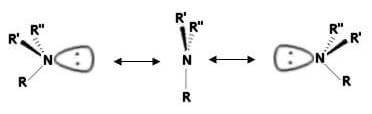
O estado de transição apresenta geometria trigonal plana.
Basicidade de aminas
Aminas (assim como amônia) são substâncias que têm um caráter básico fraco na água. Graças ao gibão solitário no átomo de nitrogênio, cada amina pode remover um próton da água e se tornar seu ácido conjugado (R3N.H+):
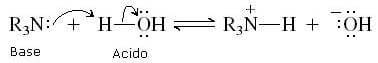
A basicidade constante para esta reação é:

A basicidade das aminas depende significativamente dos substituintes ligados ao átomo de nitrogênio.. Alquilaminas (R-NHdois) por exemplo são mais básicos que amônia: em particular metilamina (CH3-N.Hdois) é aproximadamente 22 vezes mais básico que a amônia.
O grupo metil da metilamina é, de fato, um grupo repelente de elétrons e, por efeito indutivo, estabiliza a carga positiva presente no ácido conjugado (R3N.H+) e mova o saldo anterior para a direita.
As aminas secundárias são um pouco mais básicas que as aminas primárias., Enquanto aminas terciárias há uma mudança de direção e Portanto, eles são menos básicos que as aminas secundárias.. A razão para esse comportamento é encontrada no impedimento estérico dos três substituintes, que, entre outras coisas, também diminui o efeito da solvatação da água no íon alquil amônio (R3N.H+), tornando-o menos estável.
As aminas aromáticas, por outro lado, são bases muito mais fracas que as aminas alifáticas.. Por exemplo, a anilina tem uma basicidade que é um milhão de vezes menor que a da ciclohexilamina.
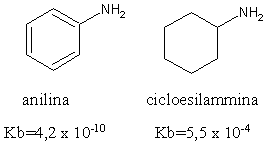
Isto é devido à deslocalização de ressonância do dubleto eletrônico presente no átomo de nitrogênio da anilina:
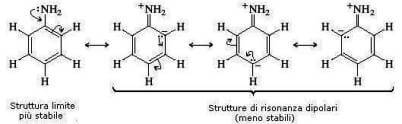
A densidade de elétrons no átomo de nitrogênio diminui e com ela sua basicidade (veja a teoria de Lewis). Isso acontece para a anilina, mas não para a ciclohexilamina.
Propriedades físicas de aminas: solubilidade e ligações de hidrogênio.
As aminas têm pontos de ebulição intermediários entre os alcanos e os álcoois (de massa molecular semelhante).
De fato, as ligações intermoleculares de hidrogênio NH-N, embora de intensidade considerável e garantam que os pontos de ebulição das aminas sejam maiores que os dos alcanos de massa molecular semelhante, são menos fortes que as ligações de hidrogênio O-H — O álcool.
Isso se deve ao fato de que o nitrogênio é menos eletronegativo que o oxigênio.
As aminas podem formar ligações de hidrogênio com a água; Por esse motivo, aminas contendo até seis átomos de carbono são altamente solúveis em água.
Alguns medicamentos como a benzedrina (que pertence à categoria de anfetaminas) são aminas.
Nomenclatura de Aminas.
Para a nomenclatura da amina, consulte: Regras da IUPAC para a nomenclatura de aminas.
Exercícios em aminas.
Você pode encontrá-los no seguinte link: exercícios sobre aminas.
Estude conosco
[ad_2]
Source link
