Como os compostos de carbono são classificados
[ad_1]
Classificação dos principais compostos de carbono
O átomo de carbono forma muito mais compostos do que os outros elementos, e quase todos os seus compostos são classificados como orgânicos, com poucas exceções.
Os compostos inorgânicos de carbono correspondem a um pequeno número: carbonatos, cianetos, cianatos e óxidos de COdois eco.
A razão para uma presença tão massiva de compostos de carbono é a própria natureza do elemento, bem resumida por sua localização na Tabela Periódica dos Elementos:
– posição número 6: número atômico = número de elétrons = 6
– grupo IV: 4 elétrons no nível de energia mais externo do átomo
– período 2: segundo nível de energia para completar
– tangente não metálica à linha de partição, ou seja, tendência a formar ligações covalentes
Isso significa que o carbono tende a formar tantas ligações covalentes quantos os elétrons em seu nível mais externo para chegar ao octeto, ou seja, a configuração mais estável por ser semelhante à do gás nobre (assim chamado por não ser reativo). . ) bem próximo, o Neon. Desta forma, não só as unidades moleculares às quais o carbono dá origem são geometricamente muito regulares (tetraedro) e caracterizadas pelo número máximo possível de ligações covalentes, mas isso é alcançado no menor espaço possível (configuração de economia de espaço). baixo número de elétrons (posição alta na tabela periódica).
Para entender completamente a peculiaridade do carbono, compare-o com o silício (símbolo químico Si), outro dos elementos mais presentes na natureza, embora mais intimamente ligado ao mundo mineral: pertence ao mesmo grupo de C e, portanto, tem uma configuração eletrônica semelhante e igualmente ótimo (número de elétrons de valência = número de orbitais de valência); Por outro lado, por pertencer ao período seguinte e, portanto, pela presença de 10 elétrons no nível de energia 2, o átomo de Si é muito mais volumoso e, portanto, incapaz de estabelecer ligações muito fortes dada a distância necessária do núcleo.
Da mesma forma, no boro (B) os únicos 3 elétrons do nível de energia mais externo disponíveis para formar ligações covalentes não são suficientes para atingir o octeto (pode atingir um máximo de 6) então as cadeias de átomos que se formam serão instáveis e reativas devido à falta de octeto; ao mesmo tempo, a própria geometria das moléculas assim formadas será pouco compatível com a formação de ligações múltiplas.
Finalmente, o nitrogênio (N) tem 5 elétrons no nível de energia externa com um excesso de dois elétrons em relação ao número de ligações covalentes necessárias para chegar ao octeto que, embora não se liguem, interagem eletrostaticamente e repulsivamente com os átomos ligados.
Em suma, as propriedades químicas versáteis do Carbono permitem que ele dê origem a cadeias de átomos (lineares, ramificadas, abertas e fechadas) por meio de ligações covalentes (simples e múltiplas) consigo mesmo ou com heteroátomos, especialmente hidrogênio (H), nitrogênio (N ), oxigênio (O), fósforo (P) e enxofre (S). Como recurso mnemônico, é aconselhável lembrar as iniciais CHNOPS!
Classificação dos compostos orgânicos de carbono mais importantes
Os critérios de discriminação são:
– tipo de heteroátomos (e grupos funcionais) ligados a C
– tipo de cadeia (linear ou cíclico)
– tipo de ligações entre os átomos de C (simples ou múltiplos)
Em particular, os átomos ou grupos de átomos ligados ao carbono desempenham um papel fundamental, pois podem modificar a tendência natural do carbono de formar, graças à regularidade geométrica do tetraedro e à eletronegatividade média de seu átomo, moléculas apolares e, portanto, hidrofóbicas. a água é composta de moléculas polares e, portanto, tende a dissolver moléculas igualmente polares). A esse respeito, consulte a tabela a seguir.

hidrocarbonetos
Formado apenas por átomos de carbono e hidrogênio.
Saturado ou parafina (apenas ligações simples entre C e, portanto, não muito reativas)
– Alcanos (cadeias abertas CnH2n + 2-ano): metano, etano, propano, butano, pentano, hexano, … icosano (20C), etc.
![]()
metano
– Cicloalcanos ou naftenos (cadeias fechadas CNorteh2nciclo–ano)
insaturado (multilinks entre C)
– Alcenos (cadeias abertas com uma única ligação dupla CNorteh2n-eno)
– Poliquenos (cadeias abertas com mais de uma ligação dupla, -dieno e -treno)
– Cicloalcenos (cadeias fechadas com uma ou mais ligações duplas, ciclo- -eno e -dieno e -treno)
– Aromático (geralmente composto por cadeias fechadas de seis átomos de C com três ligações duplas, daí os radicais arila). O benzeno pertence aos aromáticos.
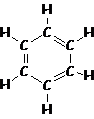
benzeno
– Alcinos (cadeias abertas com ligação tripla CNorteh2n-2-eu não)
![]()
etino ou acetileno
Álcoois (R-OH)
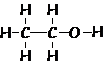
etanol ou álcool etílico CH3CHdoisooh
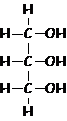
glicerol ou glicerina = propantriol
Clique para mais informações sobre álcoois
Éteres (ROR)
![]()
éter difenílico
Clique para obter mais informações sobre éteres
Fenóis (-OH em hidrocarboneto aromático)
São mais ácidos que os álcoois.
![]()
fenol (ou ácido carbólico)
Clique para mais informações sobre fenóis
Ácidos carboxílicos (-COOH)
![]()
ácido acético
Clique para obter mais informações sobre Ácidos Carboxílicos
anidridos
Assim chamados porque podem ser obtidos a partir da desidratação de ácidos.
![]()
anidrido acético
Clique para obter mais informações sobre Anidridos
Cetonas (RCOR)
![]()
cetona
![]()
acetona ou propano-um
Clique para obter mais informações sobre cetonas
Aldeído (RCOH)
![]()
aldeído
![]()
aldeído fórmico ou formaldeído ou metanal
Clique para mais informações sobre aldeídos
Estrangeiro (-COO-)
São obtidos a partir da condensação entre um álcool e um ácido. As gorduras são ésteres de glicerol com ácidos carboxílicos com alto número de átomos de C (ácidos graxos). Além disso, alguns plásticos importantes (poliésteres) são ésteres de ácidos dicarboxílicos (ou anidridos) e álcoois com pelo menos dois grupos -OH.
Clique para mais informações sobre países estrangeiros
Aminas (-NHdois)
O grupo amino e o grupo carboxílico podem estar presentes simultaneamente em compostos chamados aminoácidos que por polimerização (policondensação) entre eles dão origem a peptídeos e proteínas.
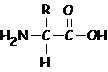
aminoácido genérico
Clique para obter mais informações sobre aminas.
estude conosco
[ad_2]
Referências
