estresse angular
[ad_1]
Contribuição para a instabilidade de uma molécula devido à deformação angular
Os ângulos entre as ligações de um átomo de carbono dependem do tipo de hibridização do próprio átomo.
Seguindo um sp3os ângulos entre os orbitais híbridos do átomo de carbono são 109,5°;
após hibridização spdois os ângulos entre os orbitais híbridos do átomo de carbono são de 120°;
após uma hibridização do tipo sp, os ângulos entre os orbitais híbridos do átomo de carbono são de 180°.
Freqüentemente, na constituição de uma molécula (como um cicloalcano), os átomos de carbono são forçados a formar ângulos de ligação C-C-C diferentes dos ideais para sua hibridização para se ligarem uns aos outros.
Por deformação angular entendemos a deformação de uma molécula devido a um desvio do ângulo de ligação do ideal para sua hibridização..
Deformação angular em ciclopropano
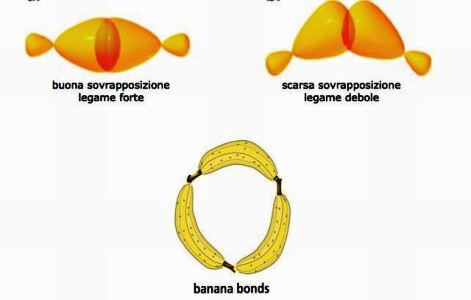
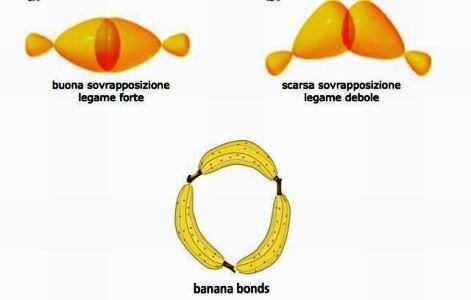
Na molécula de ciclopropano (C.3h6) o ângulo de ligação C ― C ― C é de apenas 60°, um valor muito distante do ideal de 109,5° (típico do carbono tetraédrico). Isso resulta em alta tensão angular que resulta em alta instabilidade da molécula.
De fato, no ciclopropano, a sobreposição entre dois orbitais híbridos sp3 pertencer a dois átomos de carbono adjacentes não é muito eficaz, as ligações carbono-carbono são fracas e a molécula é instável.
Tensão angular em ciclobutano
No ciclobutano, a deformação angular é menor do que no cicloproano, uma vez que os ângulos de ligação C-C-C estão mais próximos do valor ideal de 109,5°.
Deformação angular em ciclohexano
O cicloexano é caracterizado pela ausência de tensão angular, pois as ligações C ― C ― C estão dispostas a 109,5°, respeitando plenamente o valor ideal do carbono tetraédrico.
estude conosco
[ad_2]
Referências
