Geometria das moléculas

[ad_1]
Previsão da geometria das moléculas.
As ligações covalentes são ligações direcionais e, portanto, podem formar ângulos característicos entre elas que determinam a forma e, portanto, a geometria da molécula.
A geometria de uma molécula pode ser prevista aplicando a teoria VSEPR, (VSEPR é um acrônimo para o nome em inglês Repence Shell Electron Pair Repulsion, ou seja, a repulsão dos pares de elétrons do invólucro de valência).
Essa teoria permite prever a geometria molecular de substâncias das fórmulas de Lewis.
Muitas propriedades das substâncias dependem da geometria das moléculas que a compõem.
O cheiro e o sabor dos alimentos, por exemplo, são causados pelo formato de suas moléculas, mas a polaridade, o ponto de fusão e o ponto de ebulição também são propriedades que dependem da geometria molecular.
Ao estudar este tópico, recomenda-se o uso de kits de modelos moleculares necessários para entender a estrutura e a geometria das moléculas. Consulte o link para uma possível compra do produto.
Teoria do VSEPR em breve
Para uma discussão mais detalhada, remetemos para a seguinte dispensação: Teoria do VSEPR. A seguir, essa teoria será descrita apenas superficialmente.
Os dubletos eletrônicos mais externos (concha de valência) de um átomo, sendo carregados negativamente, tendem a se repelir e se posicionar o mais longe possível um do outro. Dessa maneira, a força repulsiva entre esses dupletos é minimizada e, portanto, a molécula é mais estável.
A teoria também afirma que pares solitários de elétrons (não envolvidos em ligações) tendem a ocupar um volume maior que os pares compartilhados de elétrons (isto é, aqueles envolvidos em ligações químicas) e, portanto, exercem maior força repulsiva.
Como primeira aproximação, a força repulsiva entre pares de elétrons varia da seguinte maneira:
repulsão entre gibões solitários> repulsão entre gibões solitários e gibões compartilhados> repulsão entre gibões compartilhados
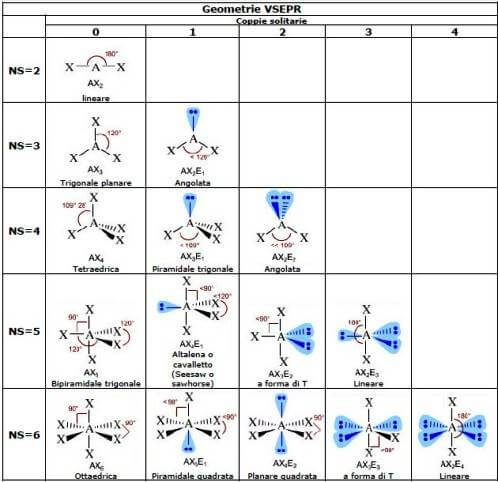
Além disso, de acordo com a teoria VSEPR, a geometria de uma molécula depende unicamente da soma entre o número de ligações (independentemente de serem únicas, duplas ou triplas) e os pares solitários presentes no átomo central.
Cada molécula pode ser representada pela fórmula genérica MACHADOnorteISTO Émetro onde A representa o átomo central, X o número de átomos ligados ao átomo central e E os pares de elétrons solitários presentes no átomo central.
De acordo com a teoria VSEPR, para determinar a geometria de uma molécula, é necessário calcular o valor do número estérico NS executando a soma entre (m + n); em outras palavras, é necessário determinar o valor de número estérico NS adicionando o número de átomos (X) anexado ao átomo central (A) e o número de pares de elétrons livres presentes no átomo central. Com base nesse valor, é possível prever a geometria da molécula.

As possíveis geometrias moleculares divididas pelo valor do número estérico NS e o número de pares solitários presentes no átomo central são mostradas abaixo:
Exercícios sobre a geometria das moléculas.
Exercícios sobre a teoria VSEPR e geometria de moléculas podem ser encontrados no seguinte link: exercícios sobre a teoria VSEPR.
Estude conosco
[ad_2]
Source link