substituição nucleofílica SN2
[ad_1]
Substituição nucleofílica bimolecular S.Não.dois
mecanismos SNão.1 e SNão.2 diferem entre si nos tempos relativos de formação do novo vínculo e quebra do vínculo antigo.
Um substituto SNão.2 tem as seguintes características:
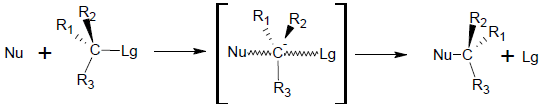
– a reação é concertado no sentido de que a formação e a quebra do vínculo ocorrem ao mesmo tempo; portanto, o mecanismo de reação fornece uma única etapa envolvendo ambas as moléculas reativas (A–Lg e Nu);
– a cinética da reação é de segunda ordem; de fato, a velocidade da reação pode ser acelerada aumentando a concentração de apenas um ou ambos os reagentes.
A lei cinética desta reação é, portanto, do tipo: v = k [R-Lg] · [Nu]
– o carbono ao qual ocorre a substituição altera sua hibridização sp3como estava no produto inicial, um spdoisuma vez que está em estado de transição;
– no estado de transição, o grupo de entrada (Nu) e o grupo de saída (Lg) se sobrepõem simultaneamente em lados opostos do orbital p, que é perpendicular ao plano que contém os outros três resíduos ligados ao carbono;
– o carbono no qual ocorre a substituição sofre uma inversão de configuração (A inversão de Walden).
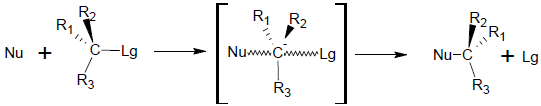
No qual:
Nu = nucleófilo
Lg = grupo de saída
Um exemplo de uma reação que prossegue através de um mecanismo de substituição nucleofílica SNão.2 é o próximo:
irmão– +CH3eu → ch3irmão + eu–
O diagrama de energia para esta reação é o seguinte:
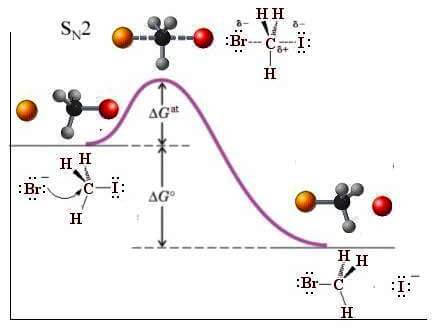
Observe que o estado de transição (energia máxima) prevê uma geometria bipiramidal trigonal na qual o grupo de entrada (Br–) e o grupo de saída (I.–) se sobrepõem simultaneamente e em lados opostos do orbital p, que é perpendicular ao plano que contém os três átomos de hidrogênio. Observe também que o carbono no qual ocorre a substituição sofre uma inversão de configuração.
Ordem de reatividade em reações SNão.dois
Foi encontrado experimentalmente que a substituição nucleofílica SNão.2 depende significativamente da estrutura do haleto de alquila, uma vez que o nucleófilo que entra deve forçar seu caminho para o átomo de carbono no lado oposto daquele que transporta o halogênio de saída, e se grupos volumosos estiverem ligados ao próprio carbono, eles o tornarão difícil para o nucleófilo entrar.
Esse fenômeno é chamado impedimento estérico para a reação SNão.dois. A reação SNão.Portanto, 2 é favorecido em relação a átomos de carbono menos substituídos (ou seja, com mais átomos de hidrogênio ligados).
A ordem de reatividade S.Não.2 é, portanto:
metil > primário > secundário > terciário
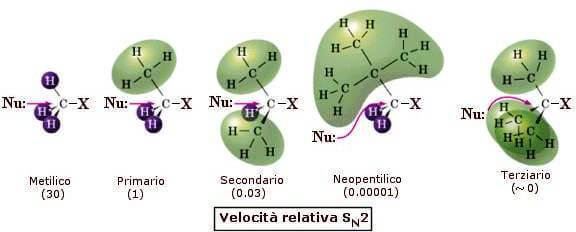
Os haletos de metila são, portanto, os mais rápidos nas substituições de SNão.2 porque eles têm apenas três átomos de hidrogênio projetados contra o nucleófilo que chega. Mesmo os haletos de alquila primários reagem rapidamente, uma vez que uma única cadeia linear ligada ao carbono no qual a inversão ocorre pode ser arranjada de uma maneira que não produz interações sensíveis. O impedimento estérico ao ataque de nucleófilos é maior nos haletos secundários, mas a reação ainda pode ocorrer a uma taxa apreciável. Com haletos terciários, o impedimento estérico torna-se quase proibitivo.
Natureza do nucleófilo
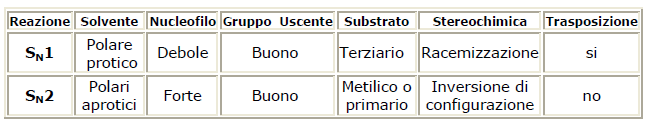
A natureza do nucleófilo também influencia a reação S.Não.2. O SNão.2 requer nucleófilos fortes e para favorecer o ataque eletrofílico, é preferível o uso de solventes polares apróticos (ou seja, não liberam íons H).+). A natureza do grupo de saída também influencia a reação S.Não.2. De fato, uma Lg muito boa tende a sair antes mesmo do ataque do nucleófilo favorecendo uma reação SNão.1; a reação SNão.2 é, portanto, favorecido por Lgs fracos.
Em suma, uma reação SNão.2 é favorecido por:
- grupos Lg fracos (Lg = grupo de saída = grupo de saída)
- nucleófilos fortes;
- haletos de alquila primários ou secundários.
estude conosco
[ad_2]
Referências