Tabela periódica de Mendeleev

[ad_1]
A tabela periódica de Mendeleev e a descoberta da periodicidade.
Tentativas de classificar elementos químicos em grupos cujos componentes tinham semelhanças entre eles foram muitas: JW Doebereiner em 1829 expôs a teoria das tríades. Nesta teoria, elementos como cloro, bromo, iodo ou cálcio, estrôncio e bário foram agrupados, bastante semelhantes.
Alcançado em 1858 com a regra de S. Cannizzaro um determinado critério para a escolha de pesos atômicos, em 1862, a AEB de Chancourtois ordenou os elementos de acordo com seus pesos atômicos espirais, de modo que outros semelhantes foram encontrados um abaixo do outro e em 1864 O JAR Newlands enunciou a lei da oitava.
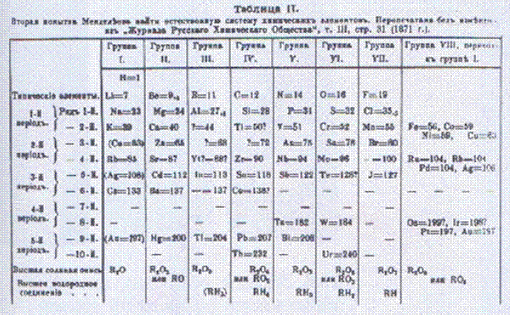
Finalmente, em 1869, o químico russo DI Mendeleev propôs um sistema periódico dos elementos, ou seja, uma classificação dos elementos a partir dos quais a variação periódica de suas propriedades químicas e físicas emerge claramente quando ordenada de acordo com os valores crescentes de seu peso atômico. O alemão JL Meyer no ano seguinte fez considerações substancialmente semelhantes, usando variações no volume atômico como critério de inclusão.
Portanto, independentemente um do outro, Mendeleev, na Rússia, e Meyer, na Alemanha, descobriram que, se os elementos químicos são organizados de acordo com o aumento da massa atômica, suas propriedades são periódicas, ou seja, são repetidas regularmente.

Químico russo Dmitry Ivanovich Mendeleev (Tobolsk, 8 de fevereiro de 1834 – São Petersburgo, 2 de fevereiro de 1907).
Com base nessas descobertas, em 1869, Mendeleev desenvolveu uma tabela periódica na qual todos os elementos conhecidos até agora eram classificados de acordo com a massa atômica crescente. Às vezes, essa regularidade era interrompida e, portanto, deixava espaços vazios aguardando a descoberta desses elementos.
Alguns anos depois, o gálio e o germânio foram descobertos, elementos previstos por Mendeleev que preenchiam os espaços vazios de sua tabela periódica.
O fato de o sistema periódico ser agora atribuído apenas a Mendeleev deve-se ao fato de ele ter publicado os resultados alguns meses antes de Meyer, mas a contribuição de ambos foi reconhecida pela Royal Society, que em 1882 designou Davy e Mendeleev à medalha de Meyer.
O esquema de classificação de Mendeleev foi realmente surpreendente, porque na mesma coluna havia elementos que tinham as mesmas propriedades químicas.
Mais tarde, B. Brauner (1899) adicionou o sistema periódico ao grupo de gases nobres (descoberto entre 1894 e 1898 por RG Rayleigh e G. Ramsay) e agrupou os elementos conhecidos como lantanídeos ou lantanóides.
A tabela de Mendeleev, no entanto, não conseguiu explicar algumas coisas, como o fato de que o cobalto, embora tenha uma massa atômica maior que a do níquel, possui propriedades que levariam a colocá-lo diante desse elemento; O esquema de Mendeleev apresentou anomalias: para levar em conta as propriedades dos elementos, ele foi forçado a não seguir o critério de progressividade dos pesos atômicos no caso dos pares Ar-K, Co-Ni e Te-I.
Em 1913, GJ Moseley entendeu que o parâmetro de ordem dos elementos na tabela periódica não era a massa atômica, mas o número atômico; Dessa maneira, a posição do cobalto é precisamente a que precede o níquel. Portanto, somente com os dados da estrutura atômica foi possível estabelecer que no sistema periódico os elementos são ordenados de acordo com seu peso atômico, mas com o número atômico crescente, ou seja, o número de prótons existentes no núcleo atômico. de cada elemento químico.
Nos anos seguintes, finalmente chegamos a esclarecer o arranjo dos elementos na tabela periódica e chegamos ao que é chamado de tabela periódica dos elementos.
A tabela periódica moderna
O sistema periódico moderno destaca a existência de elementos cujas propriedades físicas (densidade, potenciais de ionização, volume atômico) e químicas (valência, eletropositividade etc.) são semelhantes e aparecem em intervalos fixos e recorrentes.
Essas semelhanças vêm de configurações eletrônicas semelhantes dos elétrons periféricos e, por sua vez, estão em correlação direta com o número atômico dos respectivos átomos. Isso é resumido enunciando a lei periódica, que diz que as propriedades dos elementos são funções periódicas de seus números atômicos.
Considere os gases nobres no sistema periódico; eles têm números atômicos 2, 10, 18, 36, 54 e 86 e cada um é imediatamente precedido por elementos que possuem propriedades semelhantes (halogênio) e imediatamente seguido por elementos que também possuem propriedades semelhantes (metais alcalinos).
As séries de elementos que existem entre um gás nobre e outro constituem os períodos de classificação e é o arranjo desses períodos de elementos em linhas horizontais uma acima da outra que dá origem à tabela periódica. Portanto, as colunas verticais obtidas dessa maneira agrupam elementos que possuem propriedades semelhantes e constituem os grupos do sistema periódico.
O primeiro período, também chamado de “período muito pequeno”, contém apenas dois elementos, hidrogênio e hélio. O segundo e o terceiro períodos, também chamados de primeiro período pequeno e segundo período pequeno, contêm oito elementos que variam, respectivamente, de lítio a neo e de sódio a argônio.
O quarto, quinto e sexto períodos, também chamados de primeiro, segundo e terceiro períodos principais, contêm 18 elementos, do potássio ao criptônio e do rubídio ao xenônio nos dois primeiros períodos e 32 elementos do terceiro (do césio a radão).
Os números dos elementos contidos nos períodos subsequentes são unidos como a série do dobro dos quadrados dos números naturais (2xndois) O sétimo período, também chamado de quarto grande período, começa com o francium (número atômico 87) e agora termina com o elemento do número atômico 105 (nome proposto: dubnium).
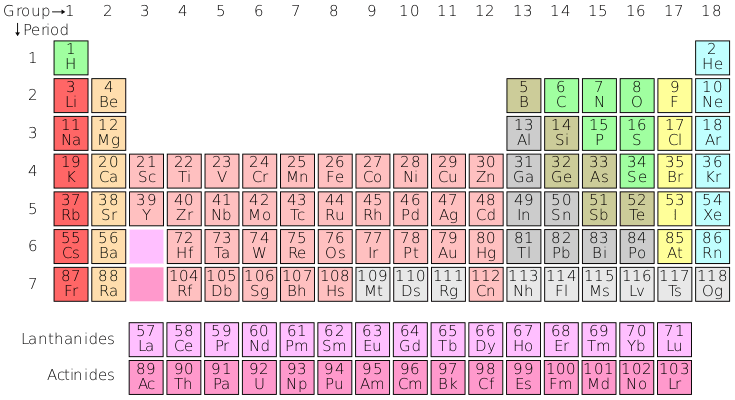
Os elementos de transição são aqueles que no sistema periódico estão no meio dos grandes períodos e aparecem, no primeiro grande período, com o elemento do número atômico 21 (escândio) e nos períodos posteriores com o ítrio (número atômico 39) , lantânio (número atômico 57) e actínio (número atômico 89): neles, em vez de serem colocados na camada orbital mais externa, os elétrons posteriores são inseridos na camada mais interna imediata, o que às vezes causa o aparecimento de paramagnetismo , a coloração dos íons e a variabilidade da valência
Finalmente, com o elemento lantânio do número atômico 57, no terceiro grande período (o primeiro contendo 32 elementos) começa uma família de 14 elementos, além do lantânio (18 + 14 = 32), extraordinariamente semelhantes entre si, chamados elementos Terra rara ou série de lantanídeos: neles os elétrons traseiros ocupam ainda mais órbitas internas e a semelhança da estrutura eletrônica externa justifica a semelhança das propriedades.
Fenômeno semelhante se repete no quarto período principal após o elemento actínico do número atômico 89, que constitui o início da série de actinídeos, aos quais, portanto, além dos elementos actínio, tório, protactínio e urânio, pertencem todos transuranicos a laurenzio (para elementos transuranicos com números atômicos maiores que 92).
Valenza
Quanto às propriedades comuns dos grupos do sistema periódico, que serão limitadas apenas à variação da valência, será dito que possui um valor igual ao número progressivo do grupo ao qual os respectivos elementos pertencem aos compostos oxigenados, enquanto em os compostos com hidrogênio, a valência aumentam de 1 para 4 do primeiro para o quarto grupo, para diminuir de 4 para 1 do quarto para o sétimo grupo. A soma da valência máxima em relação ao oxigênio e ao hidrogênio no quarto ao sétimo grupos permanece igual a 8.
Por fim, deixamos alguns links que podem lhe interessar:
Deseja saber quantos elementos da tabela periódica existem?
Qual é a tabela de produtos químicos?
Lista numérica alfabética e atômica de elementos químicos.
Quais são os blocos na tabela periódica?
Estude conosco
[ad_2]
Source link