Definição e equação de pH em química
[ad_1]
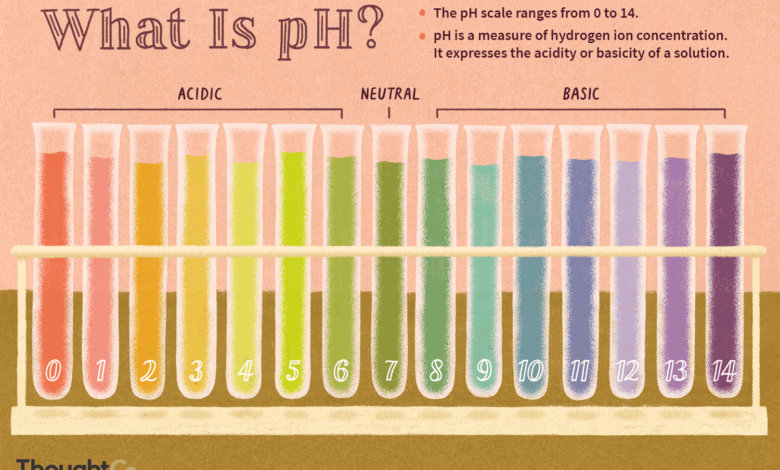
O pH é uma medida da concentração de íons de hidrogênio, uma medida da acidez ou alcalinidade de uma solução. A escala de pH varia tipicamente de 0 a 14. Soluções aquosas a 25°C com pH abaixo de 7 são ácidas, enquanto aquelas com pH acima de 7 são básicas ou alcalinas. Um nível de pH de 7,0 a 25°C é definido como “neutro” porque a concentração de H3OU+ é igual à concentração de OH– em água pura. Ácidos muito fortes podem ter pH negativo, enquanto bases muito fortes podem ter pH maior que 14.
equação de pH
A equação para calcular o pH foi proposta em 1909 pelo bioquímico dinamarquês Søren Peter Lauritz Sørensen:
pH = -log[H+]
onde log é o logaritmo na base 10 e [H+] representa a concentração de íons de hidrogênio em unidades de mols por litro de solução. O termo “pH” vem da palavra alemã “potencial”, que significa “potência”, combinada com H, o elemento símbolo do hidrogênio, então pH é a abreviação de “poder do hidrogênio”.
Exemplos de valores de pH de produtos químicos comuns
Trabalhamos com muitos ácidos (pH baixo) e bases (pH alto) todos os dias. Exemplos de valores de pH para produtos químicos de laboratório e produtos domésticos incluem:
0: ácido clorídrico
2.0: suco de limão
2.2: vinagre
4.0: vinho
7.0: água pura (neutra)
7.4: sangue humano
13.0: alvejante
14.0: hidróxido de sódio
Nem todos os líquidos têm um valor de pH
O pH só tem significado em solução aquosa (em água). Muitos produtos químicos, incluindo líquidos, não possuem valores de pH. Se não houver água, não há pH. Por exemplo, não há valor de pH para óleo vegetal, gasolina ou álcool puro.
Definição de pH da IUPAC
A União Internacional de Química Pura e Aplicada (IUPAC) tem uma escala de pH ligeiramente diferente que se baseia em medições eletroquímicas de uma solução tampão padrão. Essencialmente, a definição usa a equação:
pH = -log aH +
onde umH + significa atividade de hidrogênio, que é a concentração efetiva de íons de hidrogênio em uma solução. Isso pode ser ligeiramente diferente da concentração real. A escala de pH IUPAC também inclui fatores termodinâmicos que podem influenciar o pH.
Para a maioria das situações, a definição de pH padrão é suficiente.
Como o pH é medido
Medições aproximadas de pH podem ser feitas com papel de tornassol ou outro tipo de papel de pH conhecido por mudar de cor em torno de um determinado valor de pH. A maioria dos papéis e indicadores de pH são úteis apenas para dizer se uma substância é um ácido ou uma base ou para identificar o pH dentro de uma faixa estreita. Um indicador universal é uma mistura de soluções indicadoras destinadas a fornecer uma mudança de cor em uma faixa de pH de 2 a 10.
Medições mais precisas são feitas usando padrões primários para calibrar um eletrodo de vidro e um medidor de pH. O eletrodo funciona medindo a diferença de potencial entre um eletrodo de hidrogênio e um eletrodo padrão. Um exemplo de eletrodo padrão é o cloreto de prata.
Usos de pH
O pH é usado na vida cotidiana, bem como na ciência e na indústria. É usado na culinária (por exemplo, reagindo o fermento em pó e um ácido para fazer os produtos de panificação crescerem), na elaboração de coquetéis, em produtos de limpeza e na preservação de alimentos. É importante na manutenção de piscinas e purificação de água, agricultura, medicina, química, engenharia, oceanografia, biologia e outras ciências.
[ad_2]
referências