Hibridização de carbono

[ad_1]
Hibridização orbital: definição e explicação
Considere o átomo de carbono: a configuração eletrônica do carbono é 1sdois 2sdois 2 Pdois.
Como você pode ver, o carbono tem apenas dois orbitais 2p meio cheios e, portanto, deve levar apenas a duas ligações covalentes.
Realmente carbono como no metano CH4 4, é predominantemente tetravalente, ou seja, capaz de formar 4 ligações com outros átomos.
a promoção de um elétron do orbital 2s para o orbital 2p vazio.
Esse átomo de carbono excitado agora tem quatro orbitais meio cheios e pode formar quatro ligações:
No entanto, como o orbital atômico esférico 2s tem menos energia e forma diferente dos três orbitais 2pX2 Pe2 PzDevemos esperar três links iguais e um link diferente.
Tudo isso contrasta com os fatos experimentais que determinam a presença de metano (CH4) de 4 ligações covalentes idênticas.
Hibridação sp3 – único link –
A teoria sugere o “mistura“do orbital 2s com os três orbitais 2p. Essa mistura é matemática, das funções de onda do orbital e, portanto, não é um fenômeno físico real.
Como resultado, 4 novos orbitais idênticos em forma, energia e disposição no espaço são completamente diferentes do original. Essa operação matemática é chamada hibridização.
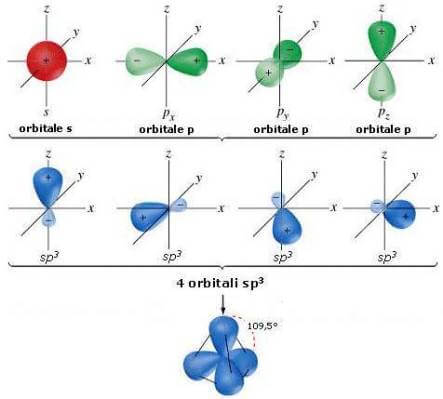
Os novos 4 orbitais híbridos, chamados sp3, possui 1/4 das características do orbital inicial e 3/4 das características dos orbitais 2p. O expoente 3 de p indica o número de orbitais p que participam da formação do híbrido.
Os orbitais híbridos de 4 sp3 eles são idênticos entre si e têm a seguinte forma:

O lóbulo maior é o usado nos links. Às vezes, por razões práticas, o lobo menor não é representado.
Os quatro orbitais híbridos sp3 apontam para os vértices de um tetraedro, sendo 109,5 ° um do outro:
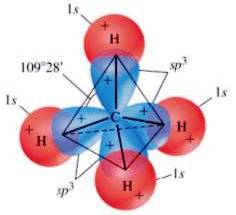
Na formação da molécula de metano, há uma sobreposição entre os 4 orbitais sp híbridos.3 e 4 orbitais 1s pertencentes a 4 átomos de hidrogênio diferentes:
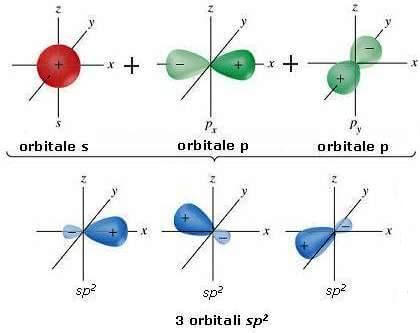
Hibridação spdois – ligação dupla –
Além da hibridação sp3 Existem também outras hibridizações. 3 orbitais híbridos chamados orbitais sp são obtidos misturando um orbital s com dois orbitais do tipo pdois eles são dispostos em um plano em ângulos de 120 ° entre si (geometria trigonal plana).
O orbital p não envolvido na hibridação é organizado perpendicularmente ao plano formado pelos três orbitais sp híbridos.dois
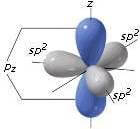
Eles têm sp. Hibridizaçãodois átomos de carbono ligados por uma ligação covalente dupla (> C = C <), como por exemplo na molécula de eteno (ou etileno) HdoisC = CHdois. A ligação dupla C = C ocorre após a sobreposição frontal entre dois orbitais híbridos spdois e a sobreposição lateral entre os 2 orbitais p que não participam da hibridação.
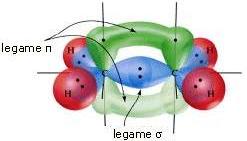
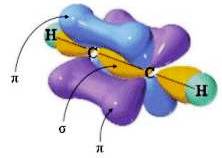
Hibridização sp – ligação tripla –
A combinação de um orbital do tipo p e um orbital do tipo p resulta em 2 orbitais sp híbridos. Cada sp orbital híbrido tem 50% de caracteres se 50% de caracteres p.
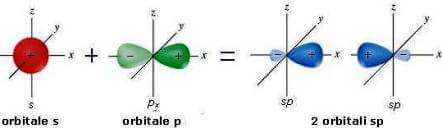
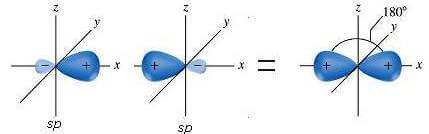
Os dois orbitais sp híbridos (nos quais, por razões práticas, o menor lóbulo é omitido) estão dispostos a 180 ° de distância (geometria linear).
Os orbitais p que não participam da hibridação estão dispostos perpendicularmente um ao outro e são perpendiculares aos dois orbitais sp híbridos:
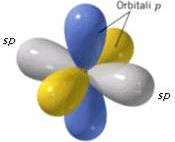
Os átomos de carbono ligados por uma ligação covalente tripla (-C≡C-), como por exemplo na molécula de etina HC≡CH, exibem sp. A ligação tripla -C≡C- ocorre após a sobreposição frontal entre dois orbitais sp híbridos e a sobreposição lateral entre os dois pares de orbitais p que não participam da hibridação.
Estude conosco
[ad_2]
Source link